2017-6-17 19:30 |
Технология выращивания миниатюрных человеческих органов из стволовых клеток стала активно развиваться только в последнее десятилетие. Однако ученые уже смогли получить в лабораторных условиях аналоги сердца, почки, головного мозга, желудка, легких, сетчатки, толстого и тонкого кишечника и так далее.
В них есть группы дифференцированных клеток, подобные тем, что имеются в полноразмерных органах.
Чтобы получить органоид, стволовые клетки помещают в среду, которая позволяет им формировать трехмерную структуру. Там они самоорганизуются и дифференцируются в клетки различных типов, повторяя с некоторой степеню точности строение и даже функции реального органа. Такие органоиды уже служат для испытаний лекарств, но не менее важна их роль для фундаментальных исследований, так как с их помощью можно установить генетические механизмы формирования настоящих органов в ходе развития эмбриона. О таких исследованиях мы уже однажды рассказывали в очерке «Органы из пробики».
Развитие любого органа определяется сложным алгоритмом, предусматривающим включение и отключение конкретных генов в нужные моменты. Ученые только начинают узнавать детали этой программы. Позволяет сделать это новая технология - секвенирование РНК из одиночной клетки (single-cell RNA sequencing). Чтение молекул РНК дает возможность определять, какие гены работают в данный момент, так как именно с помощью так называемых информационных, или матричных РНК закодированная в генах информация передается в рибосомы, где происходит синтез белков. РНК - короткоживующая молекула, поэтому конкретную матричную РНК можно встретить, только во время работы связанного с ней гена, не раньше и не позже.
Поэтому ученые выращивают из стволовых клеток, помещенных в объемную среду, органоид и в процессе его развития определяют, секвенируя РНК отдельных клеток, какие гены и насколько активны в данный момент. Специалист по биологии развития Джейсон Спенс (Jason Spence) из Мичиганского университета говорит, что секвенирования одиночных клеток - прекрасный способ описать эти процессы с достаточной степенью строгости.
Использование органоидов позволяет к тому же значительно легче, чем, например, исследования на лабораторных животных, применять различные способы воздействия на генетическую активность клеток. Можно удалять или вставлять отдельные гены при помощи специально сконструированных вирусов или же использовать метод точечного редактирования генома CRISPR/Cas9. А потом смотреть, какой эффект вызвали эти изменения. Биологи даже научились заражать органоиды различными бактериальными или вирусными инфекциями, чтобы определить молекулярный механизм болезни. Сейчас, например, так изучают воздействие на мозг вирусной лихорадки Зика. Кроме того, были разработаны системы совместного культивирования нескольких органоидов, воспроизводящие строение участков организма, включая сеть нейронов и клетки иммунной системы.
На прошлой неделе в журнале Nature было опубликовано самое подробное на настоящий момент исследование формирования из стволовых клеток миниатюрной печени. Один из ее авторов - Таканори Такебе (Takanori Takebe), работающий в университетах Иокогамы и Цинциннати - заинтересовался, можно ли использовать искусственно выращенную ткань печени для трансплантации пациентам. Он научился успешно выращивать в своей лаборатории миниорганы размером всего несколько миллиметров из плюрипотентных стволовых клеток, которые дифференцировались в клетки-предшественники гепатоцитов, мезенхимальные и эндотелиальные клетки.
Но он понимал, что печень из чашки Петри может отличаться от органа естественного происхождения. Внимание Такебе привлекла работа Барбары Третлейн (Barbara Treutlein) из Института молекулярной клеточной биологии и генетики Общества Макса Планка. Барбара руководит лабораторией, которая специализируется на секвенировании РНК одиночных клеток. В работе, на которую обратил внимание Такебе, она исследовала активность генов при формировании легких у эмбрионов летучих мышей. Таканори Такебе предложил ей совместно изучить генетические механизмы роста минипечени из стволовых клеток. Ученых больше всего интересовало взаимодействие разных типов клеток во время формирования органа, ведь иногда сигналом для запуска какого-либо гена в клетке служит белок, выделяемый соседней клеткой другого типа. Среди ведущих авторов работы были также Кейсуке Секине (Keisuke Sekine) из Иокогамы и Дж. Грей Кэмп (J. Gray Camp) из отдела эволюционной генетики Института эволюционной антропологии Общества Макса Планка.
По методу Таканори Такебе выращивались миниатюрные печени, и на разных этапах их развития исследователи брали клетки и секвенировали из них все молекулы РНК, кодирующие белки, определяя активность генов. Каждый раз они получали полный набор активных факторов транскрипции (белков, управляющих работой других генов), сигнальных белков и рецепторов, задействованных в этот конкретный момент.
Для сравнения активность генов также исследовалась в клетках человеческих эмбрионов и в клетках печени взрослого человека. Согласно полученным данным, закономерности работы генов в органоидах весьма близки процессам в естественной эмбриональной печени, но отличаются от печени взрослого.
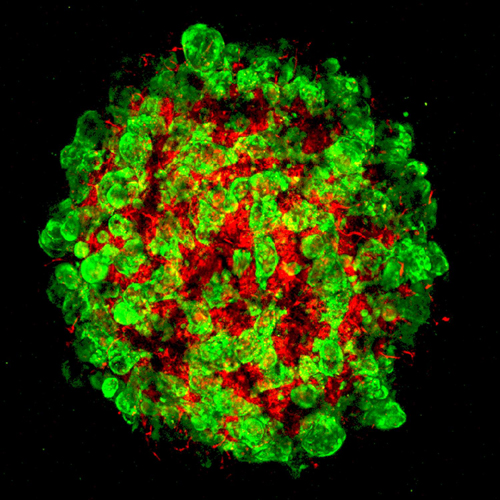
Органоид печени, выращенный исследователями из плюрипотентных стволовых клеток человека. Зеленым окрашены гепатоциты, красным - клетки кровеносных сосудов.
В частности впервые в истории авторам удалось определить белки, которые обеспечивают коммуникацию между разными типами клеток в развивающемся органоиде. Для проверки своих результатов исследователи создали много новых маленьких печеней, но при их развитии в среду добавляли ингибиторы, блокирующие действие сигнальных белков. Это позволило ученым по своей воле отключать или включать процессы клеточной дифференциации и формирования органа.
Также им удалось установить роль гипоксии - нехватки кислорода - в процессе роста органоида. Когда скопление клеток становится слишком большим, те клетки, что находятся внутри, начинают испытывать дефицит кислорода. Это заставляет клетки, которые должны дать начало кровеносным сосудам, начать производство белков, ответственных за этот процесс. Если после этого пересадить органоид в печень лабораторной мыши, он сможет подсоединить свои формирующиеся сосуды к ее кровеносной системе.
«Возможность создания биоинженерной трансплантируемой печени или тканей печени будет весьма полезна для людей, страдающих заболеваниями печени, для спасения жизни которых нужны инновационные методы лечения, - прокомментировал Таканори Тейкбе полученные результаты. - Наши данные дают новое, детальное понимание межклеточной коммуникации между развивающимися клетками печени и показывают, что мы можем создавать фрагменты человеческой печени, которые очень удивительно близки к образованиям из эмбриональных клеток, появляющимся в ходе естественного развития человека».
В мае этого года журнал Nature Cell Biology опубликовал другую работу, в которой проверялась возможность использования выращенных в лаборатории миниатюрных легких для исследования вирусных респираторных исследований и муковисцидоза. Коллективом исследователей из Колумбийского университета руководил профессор Ханс-Виллем Снук (Hans-Willem Snoeck). Ученые вырастили модельные органоиды из плюрипотентных стволовых клеток, добившись, чтобы в них возникли аналоги разветвляющихся ветвей бронхов, завершающихся альвеолами. Потом органоиды подвергали воздействию вируса или же, редактируя клеточный геном, воспроизводили мутацию, ответственную за муковисцидоз. В обоих случаях они наблюдали эффекты, характерные для данного заболевания, а значит, такие минилегкие можно использовать в поисках эффективных методов лечения.
Также в этом году группа ученых из США начала использовать миниорганы при лечении рака простаты. Врачи под руководством Хатема Сабауи (Hatem Sabaawy) из Института исследований рака Ратгерского университета (Rutgers Cancer Institute of New Jersey) решили выращивать модельные опухоли из клеток, взятых у пациентов, и подвергать их воздействию препаратов, предложенных для лечения этих пациентов. Если препарат покажет свою эффективность, его будут давать больному.
Культуры опухолевых клеток для испытаний различных средств терапии выращивают уже давно, но исследователи считают, что плоская опухолевая ткань в чашке Петри недостаточно отражает сложность опухоли и плохо предсказывает, как пациенты будут реагировать на лечение. Поэтому они решили построить трехмерные аналоги пораженного опухолью органа. Исследователи также намерены секвенировать ДНК опухолевой ткани, чтобы создать банк генетических профилей, который можно будет использовать для лечения других пациентов.
Профессор Ханс Клеверс (Hans Clevers) из Института Хюбрехта Нидерландской королевской академии наук в данный момент руководит аналогичным проектом, в котором исследуются опухоли толстой кишки. Он говорит, что, хотя исследование находится на ранней стадии, результаты, полученные с первыми пациентами, выглядят многообещающими. По словам Клеверса, лабораторные исследования позволяют подобрать наиболее действенный препарат для конкретного больного и избежать использования тех лекарств, к которым клетки данной опухоли устойчивы. До конца года в Нидерландах будут начаты еще два проекта изучения рака на органоидах, один будет посвящен колоректальному раку, другой - раку молочных желез.
Джатин Ропер (Jatin Roper), руководитель Центра исследований наследственного рака желудочно-кишечного тракта в Медицинском центре Тафтс в Бостоне, сочетает использование органоидов с исследованиями на лабораторных животных. Миниорганы, моделирующие ткань толстого кишечника с опухолью, выращиваются в лаборатории, а затем имплантируются в кишечник мыши. Там клетки опухоли вступают во взаимодействие с другими клетками кишечника, что позволяет исследователям наблюдать рак в более естественной среде, Различные генетические варианты при этом воспроизводятся при помощи технологии CRISPR/Cas9.
.Аналог Ноткоин - TapSwap Получай Бесплатные Монеты
Подробнее читайте на polit.ru
| Источник: polit.ru | Рейтинг новостей: 309 |

