2015-8-11 13:27 |
В научно-популярном разделе журнала Nature недавно была опубликована обзорная статья, посвященная теме так называемых органоидов - примитивных миниатюрных аналогов настоящих органов, выращенных в лаборатории в пробирках.
Честно говоря, надеяться на то, что такие органоиды в ближайшем будущем решат проблемы дефицита и тканевой совместимости донорских органов не приходится. Попытки терапевтического применения органоидов единичны и, кроме одного случая, о котором мы еще расскажем, ограничиваются трансплантацией отдельных клеток, иногда тканей, а не органоидов целиком.
Значительная часть исследований с использованием органоидов проводится в фундаментальных целях, остальные - для изучения действия лекарств. Многие лекарства действуют на людей избирательно: на одних действуют, на других не действуют. Причины этого не всегда известны, вероятно, они кроются в пока не выявленных генетических различиях. Создав из собственных клеток пациента соответствующий болезни органоид (на это обычно уходит 2-3 недели), можно выяснить, какие лекарства будут эффективны. Кроме того, на органоидах можно проверять токсичность лекарств. Обычно, прежде чем перейти к людям, лекарства тестируют на животных, метаболизм которых может отличаться от человеческого. Результаты экспериментов на органоидах из человеческих клеток будут обладать лучшей предсказательной способностью и будут более этичными.
Ученые экспериментируют с органоидами не потому, что это обещает в ближайшем будущем решить какую-то серьезную проблему человечества, а потому, что могут.
На самом деле, как это часто случается в быстро развивающихся науках, ученые экспериментируют с органоидами не потому, что это обещает в ближайшем будущем решить какую-то серьезную проблему человечества, а потому, что могут. В некоторых случаях органоиды образовывались как побочный продукт экспериментов, исследователи обнаруживали это и начинали искать применения.
В самом деле, в том, что органоиды образуются сами по себе, нет ничего непостижимого. Человеческий организм, да и организм представителя любого другого вида, развивается из оплодотворенной яйцеклетки без подсказок со стороны. Это значит, что с самого начала в нем заложена вся необходимая для развития информация. Организм матери предоставляет развивающемуся плоду кислород, еду, частично защищает от инфекций и помогает утилизировать отходы, но план развития эмбриона - неотъемлемая часть самого эмбриона. Некоторые вещества-тератогены, например, талидомид или ретиноевая кислота, если их принимает беременная женщина, могут нарушать этот план развития и вызывать аномалии развития плода. Но в целом, если эмбриону не мешать тератогенами, вовремя его кормить, поставлять кислород и выводить продукты жизнедеятельности, он справляется сам.
Вопрос в том, как реализуется информация, управляющая развитием эмбриона, и можем ли мы расшифровать ее настолько точно и полно, чтобы иметь возможность из эмбриональных стволовых клеток вырастить нужный орган. Благодаря технологии получения iPS (индуцированных плюрипотентных стволовых) клеток для каждого человека можно индивидуально получить клетки, которые по своим свойствам будут незначительно отличаться от клеток эмбриона на самых ранних стадиях его развития, когда из каждой клетки может вырасти отдельный организм. Если бы сигналы, управляющие эмбриогенезом, были бы расшифрованы, из таких клеток можно было бы выращивать полностью совместимые органы для трансплантации.
Расшифровка сигналов, управляющих эмбриогенезом, пока находится в зачаточном состоянии. Но уже сейчас понятно, что не все эти сигналы происходят изнутри клетки, судьба которой определяется («На 15-й день развития включить ген А. Через три дня выключить и включить ген Б»). Часть сигналов - это химические сигналы от соседних клеток («Если рядом с тобой клетка В, и она секретирует наружу белок Г, превращайся в клетку Д») и механические сигналы от окружения («Если поверхностное натяжение достигло значения Е, превращайся в клетку Ж»). Получается, что все ткани и органы развиваются взаимосвязано, и сложно вырастить какой-нибудь орган отдельно.
Другая загвоздка кроется в том, что механические сигналы долго оставались недооцененными. Стандартная лабораторная практика - выращивать клетки прикрепленными к специальному адгезивному пластику. Клетки распластываются и образуют на поверхности чашки слой толщиной в одну клетку. Эти условия крайне далеки от тех, в которых клетки находятся внутри начавшего дробление эмбриона. В эмбрионе форма клеток ближе к сферической и со всех сторон у нее такие же соседи, образующие с ней плотные контакты.
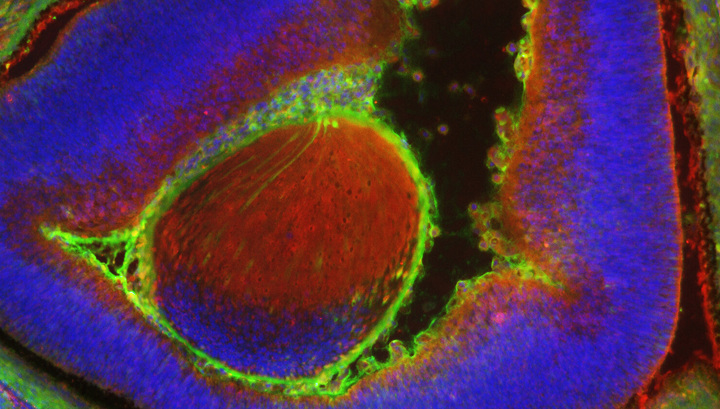
В 2011 году Мадлен Ланкастер в лаборатории в Вене удалось создать миниатюрный мозг, хотя она совсем этого не планировала. Она экспериментировала со стволовыми нервными клетками, которые должны были расти в прикрепленном состоянии. По какой-то причине клетки не захотели прикрепляться (такое может произойти, например, если случайно перепутать одинаково выглядящие чашки Петри из адгезивного и неадгезивного пластика) и начали образовывать сферы. Исследовательница заподозрила неладное, когда по бокам сфер стали появляться темные точки. Дело в том, что на определенном этапе развития мозга у него по бокам начинают сами собой образовываться зачатки глаз с пигментными клетками сетчатки. Приглядевшись к сферам внимательнее, сотрудники лаборатории обнаружили, что они содержат в себе нейроны самых разных типов и вообще очень похожи на мозг на ранних стадиях эмбрионального развития.
Удивительно, но клетки организовались совершенно самостоятельно, как только им перестали навязывать распластанное прикрепленное к дну состояние. Это, впрочем, не самый распространенный случай. Обычно все-таки приходится подбирать химические факторы (чаще белки, но не всегда) и применять их в строго определенной последовательности, чтобы получался органоид.
В других, преимущественно японских, исследованиях удалось по отдельности создать органоиды, напоминающие фрагменты нервной системы: кору больших полушарий, гипофиз и зачаток глаза. Последние два могут иметь терапевтическое применение: служить источником клеток для трансплантации людям с гипофизарной недостаточностью и с ретинопатиями.
Ученые из Утрехта сначала открыли стволовые клетки кишечника, а потом с их помощью сумели создать мини-кишку. Для этого тоже пришлось отказаться от идеи культивирования клеток в прикрепленном состоянии. Подбирая оптимальные условия культивирования, ученые решили выращивать их в матригеле - мягком желе, в котором клеткам легко поддерживать трехмерную структуру. Это привело к успеху: клетки стали формировать полые сферы, состоящие из клеток разного типа, а внутри у них образовались выросты, похожие на обычные кишечные ворсинки.
Эти сферические мини-кишки удалось приспособить для того, чтобы проверять эффективность лекарства для больных муковисцидозом. У таких больных из-за нарушения в работе ионных каналов вода все время перегоняется из межклеточного пространства внутрь клеток, а слизь, заполняющая межклеточное пространство из-за этого делается очень вязкой. Это явление затрагивает, в первую очередь, легкие и кишечник. Если вырастить мини-кишку из клеток больного муковисцидозом, то вода не проникает внутрь полой кишки-сферы. Если добавить к культивируемым органоидам эффективное для разблокирования каналов лекарство, то вода начинает проникать внутрь, и органоиды набухают. Увеличение в размерах легко заметить. Проверить свои наблюдения исследователям удалось на 100 пациентах и 6 лекарствах. Некоторым пациентам удалось подобрать действительно эффективную терапию.
Среди других мини-органов особое внимание привлекают почки. Принимая на себя многие удары, они часто выходят из строя, а донорские органы в огромном дефиците и часто плохо совместимы. При этом почка - один из самых сложноустроенных органов. Они состоят из 25-30 типов разных клеток и имеют сложную трехмерную структуру. Кроме того, эмбриональное развитие почек очень сложно - человек рождается с третьими почками, а первые две пары почек и мочеточников просто исчезают в эмбриогенезе или превращаются в другие органы.
Эксперименты на животных лучше, т. к. позволяют исследовать действие лекарств на разные системы организма, но мини-органы могут быть созданы из человеческих клеток, а разница между человеком и животными может оказаться критической.
Мелиссе Литтл удалось вырастить в своей лаборатории нечто отдаленно напоминающее эмбриональную почку, состоящую из нефронов и клеток, формирующих мочеточник. Она надеется, что после некоторого улучшения такую почку удастся трансплантировать мышам. Но им может найтись и другое применение. Такие мини-почки могут пригодиться, чтобы тестировать лекарства на нефротоксичность (распространенный побочный эффект). С некоторых точек зрения эксперименты на животных в этом смысле лучше, потому что позволяют исследовать действие лекарств на разные системы организма, но мини-органы могут быть созданы из человеческих клеток, а между разница человеком и животными может в некоторых молекулярно-биологических вопросах оказаться критической.
Один из главных успехов идеи мини-органов на сегодняшний день связан с органоидами печени. Печень тоже часто выходит из строя, и донорских органов также не хватает. Хотя печень относительно однородна по своему клеточному составу, клеточная терапия осложняется тем, что гепатоциты - взрослые клетки печени - отказываются жить и размножаться в лаборатории. В ходе эмбрионального развития для образования печени нужны сигналы от соседних клеток как мезодермального (средний зародышевый листок, формирует мышцы, кости и внутренние органы, состоящие из гладких мышц) происхождения, так и эктодермального (наружный зародышевый листок, формирует клетки кожи, эпителий внутренних органов и нервную ткань). Сама печень энтодермального происхождения. Добавив к гепатобластам клетки этих двух типов, ученым удалось заставить формироваться органоиды печени размером с печень шестинедельного эмбриона. Но оказалось, что, если ввести такие органоиды в большом количестве в отказывающую печень взрослого животного, то ее функция восстанавливается. Авторы исследования надеются в скором времени перейти к испытаниям на людях.
С точки зрения замены почки или, например, сердца более перспективна технология децеллюляризированного (бесклеточного) матрикса.
Кроме упомянутых тут органов, уже удалось получить мини-простату, мини-легкое, и даже прототип молочной железы (о некоторых из этих достижений можно прочитать в очерках «Как вырастить новые органы» и «Искусственное легкое»). Восстановление функции печени с помощью соответствующих органоидов кажется довольно реалистичной задачей, но печень относительно однородный орган, и в ней мало сложных пространственных структур. С точки зрения замены почки или, например, сердца - органов, трехмерная структура которых очень важна, более перспективной кажется технология децеллюляризированного (бесклеточного) матрикса (о ее применении рассказывается в очерках «Перепрограммированные клетки и новые органы», «Сердечный клапан из стволовых клеток» и «Как вырастить кровеносный сосуд»). Эта технология заключается в том, что из донорского органа вымываются клетки донора и остается только каркас из межклеточного вещества, которые заселяется клетками реципиента. Эта промежуточная технология позволяет сохранить трехмерную структуру и избежать отторжения нового органа иммунной системой.
Для органоидов же вполне возможны другие применения, связанные с персонализированной медициной и скринингом лекарств. Кроме того, они вносят неоценимый вклад в фундаментальную эмбриологию, позволяя определять набор факторов, нужны для развития каждого органа и ткани.
.Аналог Ноткоин - TapSwap Получай Бесплатные Монеты
Подробнее читайте на polit.ru
| Источник: polit.ru | Рейтинг новостей: 307 |