2016-3-26 15:40 |
Команда физиков из России, США и Китая под руководством профессора МФТИ Артема Оганова выдвинула теорию, объясняющую закономерности в формировании карбидов переходных металлов.
05cm;" align="JUSTIFY">Читатель, следящий за новостями науки, должно быть, уже привык - если в авторах статьи Артем Оганов, а в тексте упоминается метод компьютерного моделирования USPEX (Universal Structure Predictor: Evolutionary Xtallography), то речь, как правило, идет об открытии новых соединений. Например, всем нам знакомо соединение натрия (Na) и хлора (Cl) - поваренная соль, но, как выяснила команда Оганова, в экстремальных условиях, при высоком давлении возможны Na3Cl, Na2Cl, Na3Cl2, и даже NaCl7. В этот же раз соединение «закрыли» - выяснилось, что карбида технеция с формулой TcC не существует.
Переходные металлы.
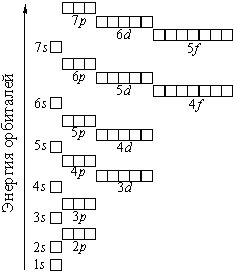
Для более понятного объяснения теории, объясняющей закономерности образования соединений углерода и переходных элементов вкратце напомним, какие именно элементы относятся к переходным, и в чем заключаются их особенности. Как известно, точная орбита электрона в атоме или молекуле не поддается расчету, но можно определить область пространства, в которой нахождение электрона наиболее вероятно (орбиталь). С ростом заряда ядра электроны заполняют все более высокие по энергии орбитали.
Рис. 1. Распределение орбиталей по уровню энергии.
Как можно заметить из рисунка, 3d-подуровень оказывается чуть выше по энергии, чем 4s. Такие «аномалии» происходят из-за того, что электроны взаимодействуют не только с ядром, но и между собой. У переходных элементов внешняя s-оболочка заполнена, и электроны начинают занимать d и f-подуровни. Поскольку химические и многие физические свойства вещества определяются типом и энергией внешних электронов по отношению к ядру, а структуры внешних электронных оболочек идентичны для всех переходных элементов, их химические и физические свойства во многом схожи.
Соединения переходных металлов и углерода интересны тем, что обладают высокой твердостью и температурой плавления, а также хорошей термической и электрической проводимостью. Эти соединения можно применять не только в качестве материалов, устойчивых в экстремальных условиях, но и в роли недорогих катализаторов, что очень важно для химической промышленности и материалостроения. Целью авторов статьи было понять механизм формирования соединений типа TMxCy (ТМ - transition metal, переходный металл, C - углерод, x и y - количества атомов каждого элемента на одну молекулу), то есть какие из них возможны и почему это так.
Почему одни карбиды стабильны, а другие -нет?
Чтобы понять процессы, происходящие при образовании карбида, физики рассмотривали атомы углерода как включения в кристаллическую структуру переходного металла. В результате внедрения углерода связи между атомами металла становятся слабее, что компенсируется образованием связей между атомами металла и углерода. Благородство переходных металлов (их нежелание образовывать химические связи с другими веществами) растет при движении вправо по таблице Менделеева, при этом энергия связей TM-C падает, и все меньшее количество атомов углерода способно проникнуть в кристаллическую решетку переходного металла. Следовательно, содержание С в соединениях TMxCy на один атом переходного металла должно падать по мере продвижения к правому краю периодической таблицы. Теория, разработанная авторами исследования, учитывает баланс этих факторов и объясняет, почему переходные металл отличаются друг от друга по способности образовывать карбида и по строению образованных соединений.
Рис. 2. Таблица переходных металлов.
Чтобы узнать, будут ли устойчивы карбиды с низким содержанием углерода (на атом металла приходится менее одного атома углерода), учеными были вычислены энергия связи атомов друг с другом (ECoh) и энергия внедрения углерода в переходном металле (EC-dis) - то есть энергия, необходимая для того, чтобы поместить углерод в кристаллическую решетку. При отрицательном значении EC-dis (это значит, что присоединение углерода выгодно) атомы углерода занимают октаэдрические (рис. 3) пустоты (междуузлия) в решетке металла.
Если рассматривать атомы как жесткие сферы, то гранецентрированная кубическая решетка - это один из вариантов расположения шаров (атомов) одинакового размера, при котором каждый шар третьего слоя расположен над лунками первого слоя. Между шарами есть пустоты (междуузлия) относящиеся к двум типам. Одни пустоты расположены между четырьмя соприкасающимися шариками (в лунке, образованной тремя шарами одного слоя, находится шар следующего слоя, лунка как бы прикрыта шаром). Центры этих четырех шаров образуют тетраэдр. Поэтому пустота называется тетраэдрической (рис. 3).
Рис. 3. Тетраэдрическая (1) и октаэдрическая (2) пустоты в двухслойной плотнейшей упаковке (а) и их положение в элементарной ячейке ГЦК решетки (б)
Другие пустоты расположены между шестью соприкасающимися шарами: три шара в одном слое находятся над тремя шарами другого слоя так, что лунки двух слоев образуют одну большую пустоту. Центры этих шести шаров расположены по вершинам октаэдра, и поэтому пустота между ними называется октаэдрической (рис. 3).
Для оценки устойчивости соединений с высоким содержанием углерода команда Оганова рассчитала энергию образования монокарбида ETMC (отрицательное число означает, что монокарбид устойчив) и ΔСchg. Последний учитывает, что при образовании соединения происходит перераспределение заряда. Чем больше это число, тем сильнее затруднено образование соединения.
Исходя из значений параметров, элементы таблицы (рис. 2) можно разбить на четыре группы. В первой группе, выделенной красной рамкой, находятся титан, ванадий, цирконий, ниобий, гафний и тантал. Для них энергия образования монокарбида и энергия внедрения углерода отрицательны, то есть процессы энергетически выгодны. Кристаллическая решетка устойчивых TiC, VC, ZrC, NbC, Hf и TaC относится к тому же типу, что и решетка NaCl - кубическая, атомы углерода находятся в октаэдрических междуузлиях.
В группе, обведенной в синюю рамку находятся молибден и вольфрам - энергия образования их монокарбидов отрицательна, и поэтому MoC и WC устойчивы, но энергия внедрения углерода положительна, и поэтому углерод находится в тетраэдрических междуузлиях решетки - так он находится в окружении четырех атомов металла, а не шести, как в октаэдрическом случае, и проигрыш в энергии минимален.
У железа, хрома, магния и технеция, отнесенных в зеленую группу, энергия образования FeC, CrC, MnC и TcC положительна, следовательно, соединение неустойчиво. Кроме того, энергия внедрения углерода тоже больше нуля - наличие его в решетке энергетически невыгодно. Но, тем не менее, карбиды с низким содержанием углерода стабильны, так как возникающие при этом искажения кристаллической решетки не столь велики. Аналогичным образом стабильны и низкоуглеродные карбиды из красной и синей групп, например, Hf3C2 и Hf6C5, хотя для этих металлов стабильны и монокарбиды.
Рутений и осмий обладают почти заполненным d-подуровнем, за счет этого они довольно инертны и неохотно образуют соединения с другими веществами. Подтверждение этому мы видим и в таблице - ETMC и EC-dis положительны и довольно велики, следовательно, нестабильны как карбиды с высоким содержанием углерода, так и с низким. Несмотря на то, что железо находится в той же группе таблицы Менделеева, в его случая формирование карбидов с высоким содержанием металла возможно за счет более низкой энергии связи атомов (5,03 электрон-вольт против 7,86 рутения и 8,50 осмия). Находящийся в одной группе с рутением и осмием, рений имеет меньшую энергию связи атомов и, казалось бы, способен образовывать соединения с углеродом. Но моделирование, проведенное с помощью алгоритма USPEX не выявило возможных устойчивых структур. Итого, рений, все же, слишком инертен, и вся группа Ru, Os, Re карбидов не образует.
А технеций?
Согласно таблице (рис. 2) - технеций относится к зеленой группе, в которой возможно образование лишь низкоуглеродных карбидов. Моделирование с помощью алгоритма USPEX подтвердило этот вывод - в системе технеций-углерод стабильными оказались Tc10C, Tc8C и Tc6C. Результат моделирования согласуется с результатами исследователей, получавших эти соединения экспериментально. Но как тогда объяснить сообщения об устойчивом ТсС, обладающим кубической решеткой с атомами углерода, расположенными в октаэдрических междуузлиях? Это портит всю красивую теорию!
К счастью, в науке любое утверждение поддается проверке. Ошибку следовало искать либо в теории, либо в эксперименте. Могло ли случится так, что за TcC приняли другое соединение? Например, в смеси, содержащей по 50% углерода и технеция могли образоваться низкоуглеродные карбиды вида TcyC, а оставшийся углерод остался «не у дел». Для того, чтобы это выяснить, был проведен ряд экспериментов. В том числе, были смоделированы результаты рентгенофазового анализа элементарного технеция в и предполагаемого ТсС (рис. 4)
Метод рентгенофазового анализа основан на том, что разные вещества имеют разное межплоскостное расстояние (шарики-атомы разных веществ отличаются по диаметру, и, следовательно, толщине слоев, которые они образуют). Поэтому на рентгенограмме каждое вещество формирует сою картину расположения линий. Анализируя расположение и интенсивность линий, можно сделать вывод о том, сколько какого вещества содержится в образце.
Рис. 4. Симуляция рентгенограмы кубических решеток технеция и монокарбида технеция. Слева приведена экспериментальная рентгенограмма из статьи “Tc carbide and new ortorhommic Tc metal phase” авторы которой утверждают, что получили ТсС.
Видно, что расположение пика на экспериментально полученной рентгенограмме (40º) совпадает с пиком кубической фазы технеция (40º), а не ТсС (36ºС). То есть, скорее всего, в интерпретации эксперимента была допущена ошибка.
Итак, как говорится, «миф разрушен». Монокарбид технеция TcC не существует, и все кусочки нашей головоломки (рис. 2, напоминает паззл, не правда ли?) встали на свои места. И вдвойне приятно, что мы знаем не только как, но и почему.
.Аналог Ноткоин - TapSwap Получай Бесплатные Монеты
Подробнее читайте на polit.ru
| Источник: polit.ru | Рейтинг новостей: 213 |