2017-1-1 19:36 |
Вторая часть обзора самых значительных открытий 2016 года посвящена науке о жизни. На этот раз особенно впечатляющими оказались достижения репродуктивной биологии: получение яйцеклеток и сперматозоидов из стволовых клеток, репродуктивное донорство.
Среди многочисленных достижений технологии редактирования генома CRISPR-Cas9 мы выбрали одну, которая поможет решить проблему герпеса.
Как искусственно получить яйцеклетки…
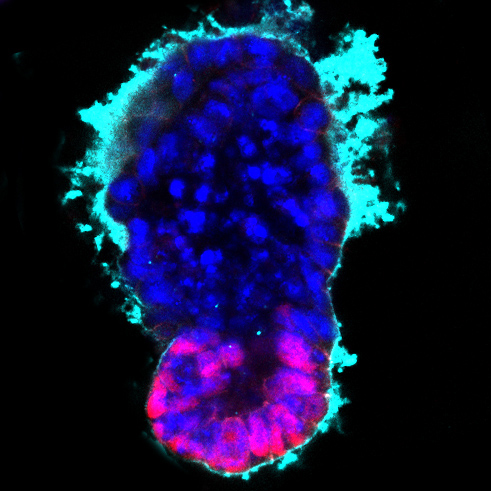
Заставить стволовые клетки превратиться в клетки нужного типа всегда непростая задача, а уж получить из них половые клетки (яйцеклетки или сперматозоиды) особенно сложно. Ранее, в 2003 году, в Пенсильванском университете из стволовых клеток были получены яйцеклетки мышей, но из этих яйцеклеток не смогли получить развивающиеся эмбрионы. В 2012 году также из мышиных эмбриональных стволовых клеток исследователи из Университета Киото под руководством Митинори Саитоу и Кацусико Хаяси получили яйцеклетки и добились рождения из них здоровых мышат. Наконец, в 2014 году ученые из Кембриджского университета и израильского Института Вейцмана сумели получить клетки-предшественники половых клеток человека из клеток кожи, при помощи регуляции работы определенных генов, но по причинам этического и юридического характера не стали продолжать эксперимент.
Теперь удалось не только заставить стволовые клетки мышей превратиться в яйцеклетки, но и добиться появления из этих яйцеклеток потомства. Исследование выполнено уже упоминавшимися Кацусико Хаяси и Митинори Саитоу и их коллегами из Университета Киото, Университета Кюсю, Токийского сельскохозяйственного университета и Института животноводства и растениеводства в Цукубе. Использовали как эмбриональные стволовые клетки мышей, так и индуцированные плюрипотентные стволовые клетки (iPS-клетки). Сначала ученые добились, чтобы развитие стволовых клеток мышей привело к появлению незрелых клеток-предшественниц яйцеклеток. Затем они поместили полученные клетки в группы клеток, взятые из яичников мышей. Их они выращивали в лаборатории в течение месяца. В результате в каждом из таких искусственных яичников получили более пятидесяти зрелых яйцеклеток. Часть этих клеток были искусственно оплодотворены мышиными сперматозоидами. Получилось более 300 эмбрионов, которые на стадии двух клеток были имплантированы самкам мышей. Однако только одиннадцать из этих эмбрионов (то есть 3 %) благополучно перенесли всю беременность. Мышата оказались здоровы и, став взрослыми, смогли произвести на свет потомство.
… а также сперматозоиды
Со сперматозоидами успехи еще скромнее, чем с яйцеклетками. Команда из Университета Киото в 2011 году смогла из стволовых клеток получить клетки, похожие на предшественники сперматозоидов, но добиться, чтобы эти клетки прошли весь дальнейший путь превращения в сперматозоиды, им не удалось. Китайским ученым удалось впервые в истории получить «в пробирке» сперматозоиды из стволовых клеток мышей. Ими экстракорпорально оплодотворили лабораторных мышей и получили от них здоровое потомство.
Чтобы добиться успеха, китайские исследователи применили ряд цитокинов, которые близки сигнальным молекулам, определяющим развитие эмбриона на начальных стадиях. В результате взятые для эксперимента эмбриональные стволовые клетки мышей удалось дифференцировать в эпибластоподобные клетки, то есть похожие на клетки желточного мешка, а затем и в гоноцитоподобные клетки. В дальнейшем авторы работы выращивали гоноцитоподобные клетки вместе с клетками эпителия семенных желез новорожденных мышей. Такой состав среды, по их мнению, наиболее точно воспроизводит ситуацию в семенных железах живой мыши. Затем в эту среду надо было добавлять вещества, которые направляли развитие гоноцитоподобных клеток в нужную сторону, а также необходимые гормоны.
По словам авторов, им пришлось проделать сотни экспериментов, прежде чем они подобрали все нужные компоненты и установили необходимый порядок этих действий. Итогом всей этой работы стали все-таки не сперматозоиды в полном смысле слова, а похожие на незрелые сперматозоиды клетки, лишенные жгутика и акросомы. Зато у них сохранялись клеточные органы, которые у нормальных сперматозоидов отсутствуют. Самостоятельно такие клетки не смогли бы оплодотворить яйцеклетку, но ученые применили метод ICSI (intracytoplasmic sperm injection) - интрацитоплазматической инъекции сперматозоида, когда сперматозоид попадает прямо в цитоплазму яйцеклетки при помощи специальной иглы. Оплодотворенные полученными клетками яйцеклетки были имплантированы в матку мыши, и в итоге родились шесть мышей. Сейчас они уже сами произвели потомство.
Достижение это настолько впечатляет, что даже не все специалисты верят, что оно осуществилось в полной мере. Если же дела обстоят действительно так, как сообщается в публикации, то надо признать, что ее авторы станут вероятными кандидатами на получение Нобелевской премии.
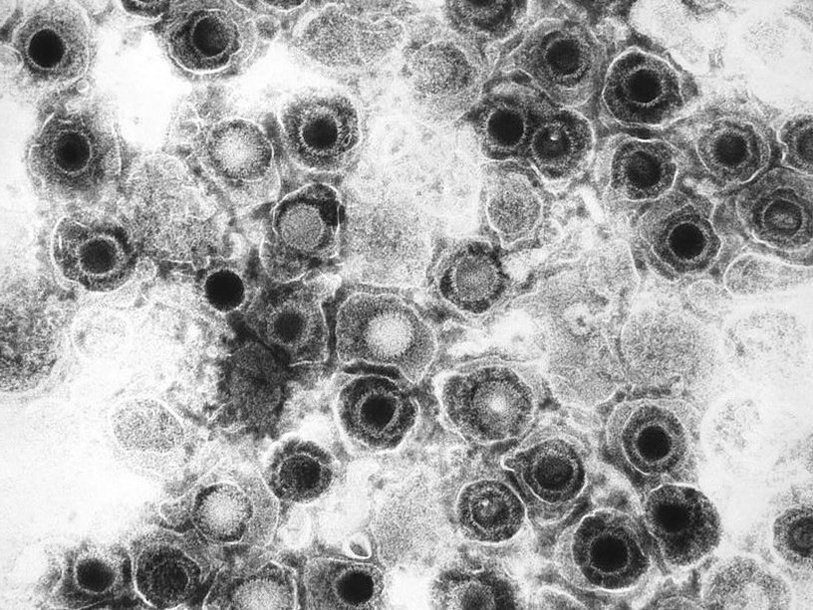
Вирус человеческого герпеса первого типа под электронным микроскопом. Фото: Wikimedia Commons
Искоренение герпеса
Очередное достижение перспективной технологии редактирования генома CRISPR-Cas9. Группа ученых из Медицинского центра Утрехтского университета (Нидерланды) сообщила об успешном эксперименте по очищению зараженных клеток от герпесвирусов. В дальнейшим полученный результат может привести к появлению метода полного излечения людей от вирусов герпеса, а также способов борьбы с другими инфекциями, имеющими латентную стадию.
После того, как человек один раз заразился вирусом герпеса, тот остается в его организме навсегда. Противогерпесные препараты могут подавить размножение вируса и предотвратить появление симптомов болезни. В нормальном состоянии организма антитела иммунной системы человека смогут самостоятельно держать вирус под контролем. Но стоит этому контролю чуть ослабнуть, болезнь проявится вновь.
«В режиме ожидания» вирусная ДНК не запускает процесс производства новых вирусов, а лишь создает особую цепочку РНК, так называемый «транскрипт латентой стадии» (HHV Latency Associated Transcript). Его роль в жизни вируса была выяснена лишь в 2008 году. Транскрипт латентной стадии разделяется на цепочки микроРНК, которые блокируют работу генов, связанных с размножением вируса. Это и обеспечивает герпесвирусам маскировку. При воздействии на организм человека стресса (например, переохлаждения) ДНК вируса начинает работать активнее. Она начинает производить больше информационной РНК, запускающей синтез необходимого для размножения белка. МикроРНК не успевают блокировать все молекулы информационной РНК, белок синтезируется, размножение вируса возобновляется - герпес выходит из подполья. Такой жизненный цикл вирусов герпеса привел к тому, что ими заражено не менее 90 % людей. Оставшиеся 10 % - это преимущественно маленькие дети, которые просто не успели повстречать вирус герпеса.
Ученые применили систему CRISPR-Cas9 к ДНК герпесвирусов трех видов. Как оказалось, разрезов в двух точках вирусного генома было достаточно, чтобы вывести из строя. Пока эксперимент был проведен в клеточных культурах, ожидается его проверка в живых организмах.
Митохондриальная ДНК. Илл. : Darryl Leja/National Human Genome Research Institute
«Ребенок трех родителей»
В течение всего года поступали новости о митохондриальном донорстве. Сначала они касались в основном обсуждения этой медицинской технологии в Великобритании, где парламент наконец-то выдал разрешение на ее практическое применение. А затем поступили новости из Мексики, где родился первый в истории ребенок с донорскими митохондриями.
Митохондрии в клетках превращают поступающие в клетку питательные вещества в молекулы АТФ, которые используются организмом как источник энергии. Когда-то митохондрии были свободноживущими бактериями, а затем стали симбионтами, превратившись в клеточный орган. У этих бактерий был свой собственный геном, и остатки его сохранились до наших дней. У животных митохондриальный геном содержит 37 генов. Как и в любой другой ДНК, в митохондриальной могут происходить мутации. Некоторые из этих мутаций вызывают болезни. При оплодотворении из сперматозоида в яйцеклетку попадает только ДНК, содержащаяся в ядре. Из-за этого следующему поколению достаются только материнские митохондрии. С митохондриальной ДНК не происходит никакой рекомбинации, ее молекулы просто удваиваются и расходятся в две новых митохондрии случайным образом. Симптомы заболевания появляются, когда аномальных хромосом становится слишком много. Поскольку рекомбинации нет, если мутация есть у матери, она обязательно окажется у всех ее детей, внуков и т. д.
Около 4000 детей в год рождаются с несовместимыми с жизнью патологиями митохондриального происхождения. Еще какое-то количество людей живет с болезнями самой разной симптоматики и тяжести течения. Всем им может помочь новая репродуктивная технология. По сути, она является вариантом экстракорпорального оплодотворения, в который добавлен еще один шаг. Для этого шага нужна донорская яйцеклетка - яйцеклетка женщины, не содержащая дефектных митохондрий. В такую яйцеклетку пересаживается ядро из яйцеклетки женщины, которая хочет стать матерью, но не может из-за мутаций в митохондриальной ДНК, или у которой высока вероятность, что ребенок будет тяжело болен. После этого яйцеклетка оплодотворяется сперматозоидами будущего отца и имплантируется, как при обычном ЭКО. Получается, что ребенок, который может родиться в ходе такой процедуры, унаследует генетический материал от трех разных человек и фактически будет иметь трех родителей.
В феврале 2015 года митохондриальное донорство было разрешено Палатой общин английского парламента. Комитет по фертильности и эмбриологии человека Великобритании (Human Fertilisation and Embryology Authority, HFEA), который лицензирует се медицинские манипуляции с эмбрионами человека, сперматозоидами и яйцеклетками в стране, попросил время для дополнительных исследований. Наконец, в конце ноября 2016 года ученые объявили, что митохондриальное донорство быть применено в ограниченных клинических испытаниях.
В сентябре этого года появилось сообщение, что родился первый ребенок после такой манипуляции. Технологию применили врачи из США в одной из больниц Мексики, воспользовавшись тем, что мексиканское законодательство не содержит запрета этого метода. Семейная пара из Иордании, которая решила прибегнуть к помощи врачей, пыталась родить ребенка в течение 20 лет. Двое рожденных ими детей умерли в раннем возрасте от генетического заболевания - синдрома Лея, еще четыре беременности закончились гибелью эмбриона. Причиной синдрома служит мутация в митохондриальной ДНК. Мальчик, получивший не материнские митохондрии с дефектной ДНК, а митохондрии женщины-донора, родился в Мексике 6 апреля 2016 года. Оповестить широкую публику о его появлении на свет врачи решили только в сентябре, когда стало ясно, что синдром Лея ему не угрожает.
Доктор Джон Чжан (John Zhang) и его коллеги, осуществившие процедуру донорства, исследовали митохондрии ребенка и обнаружили, что дефектную ДНК содержат не более 1 % из них. Врачи полагают, что этого недостаточно для проявления синдрома Лея. Согласно предыдущим исследованиям, болезнь развивается, когда число митохондрий с дефектной ДНК достигает 18 %.
.Аналог Ноткоин - TapSwap Получай Бесплатные Монеты
Подробнее читайте на polit.ru
| Источник: polit.ru | Рейтинг новостей: 255 |